医薬品承認後の安全性 [薬剤疫学 (5)]

医薬品安全性監視のことをPharmacovigilanceと言いますが、薬の副作用や問題を検出し、評価し、理解し、予防することを目的とした科学・活動のことを言います。
(* The Importance of Pharmacovigilance, World Health Organization 2002)
今回は、この”Pharmacovigilance”について解説していこうと思います。
RCTとReal-world study
「RCTは臨床試験のゴールドスタンダード」であるのは間違いないのですが、RCTで有効性が証明されたからといって、一般的な集団に投与しても同じような治療効果が出るとは限りません。
前回も少し解説しましたが、
- RCTと現実世界の集団は異なる
- RCTでの行われた医療と、現実世界で行われた医療は異なる
と言われているためです。
RCTの対象集団
多くのRCTでは、
- サンプルサイズは小さく
- 厳しい選択基準がされ
- 高い服薬アドヒアランスがされ
- 医療者による綿密なモニタリングがあり
- 経験豊富な臨床家が診療し
- 短い期間での、限られたアウトカムを評価
しています。これだけ見てもRCTがいかに実臨床から離れているかが分かると思います。
現実世界(リアル・ワールド)での集団
実臨床や通常の診療における患者集団ですが、
- 様々な背景のある患者
- 他の治療失敗の後の患者
- 並存疾患に対する併用薬がある
- アドヒアランスが低い
- 定期的に通院してくれない
など、様々な現実的な問題を抱えています。
RCTとは異なり、最適とは言えない環境で、薬剤の有効性・安全性を評価していく必要があるのです。
Pharmacovigilance (医薬品安全性監視)の価値
Pharmacovigilanceでは、発売された医薬品の有害事象の特定を担っています。
市販化された医薬品の有害事象を定量化して、どこに重点を置くのか決定する役割があります。例えば、
- 年齢
- 性別
- 併存疾患
など有害事象の原因を特定します。
あるいは、有害事象を減少させるための介入を行い、さらにその効果をモニターする場合もあります。
シグナルとは?
とある医薬品の有害事象に関する報告を「シグナル」といいます(因果関係は問わない)。
新規の有害事象など、これまでに知られていないことも多いです。
例えば、複数の症例報告があった場合など、医薬品と有害事象の関連の精査が必要なことを示唆しています。様々なケースが考えられ、例えばオフラベルで使用された場合、新規の相互作用があった場合、特定の集団のみで生じている場合などがあげられます。
シグナルの調査にも4種類あり、
- Signal detection
- Signal validation
- Signal prioritization
- Signal assessment
の4つに分類されます。
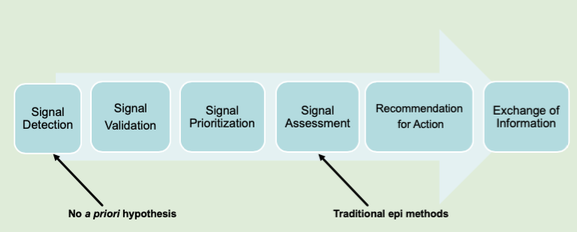
1. Signal detection
あらゆるデータを使用して、信号を検出したり識別したりするプロセスのことを「Signal detection」と言います。
2. Signal prioritization
Signal prioritizationは、シグナルの優先付けを意味します。
これは、シグナルの管理を通じて継続的に行われるプロセスです。患者又は公衆衛生へ重大に影響しうるシグナルを特定し、医薬品のリスク・ベネフィットのバランスに重大な影響を与えるシグナルを見つけることを目的にしています。
シグナルの優先付けは、迅速に行い、遅延がないように注意する必要があります。
3. Signal validation
入手可能なデータを利用して、「新たな因果関係」や「既知の因果関係の新たな側面」を示唆するのに十分なエビデンスが含まれているかを検証していきます。
検出されたシグナルを裏付けるデータを評価し、シグナルの更なる分析を正当化するプロセスです。この評価では、エビデンスの強さ、臨床的妥当性、および関連性に関する以前の認識を考慮すべきです。
4. Signal assessment
最後は「Signal assessment」ですが、該当する医薬品と副作用において、因果関係が示唆されるか決定するため、利用可能なすべてのエビデンスを考慮に入れて、シグナルをさらに評価するプロセスです。この評価では、臨床データ以外も含めることができ、情報源は可能な限り包括的であるべきです。
市販後調査の種類
市販後調査の種類ですが、大きく分けて3つあります:
- 症例報告
- 観察研究・RCTの追試
- サーベイランス
1. 症例報告
安全性のシグナル検出に用いられる症例は、多くは自発的な報告になります。国レベルのものですと、FAERS、PMDA DB、EudraVigilance、Vigibaseなどがあります。医学雑誌などの症例報告も大切なシグナル検出の材料となります。
FARESは「FDA Adverse Event Reporting System」の略ですが、FDAにおける副作用報告システムのことを言います。
FAERSは、FDAに提出された有害事象(AE)および投薬ミス報告(自発報告)に関する情報を集めたデータベースです。米国では医療者からの有害事象および投薬ミスの報告は任意です。
一方で、製造業者の報告義務化されており、新しい医薬品(FDA承認3年以内)については四半期ごと、その他については毎年FDAに非緊急報告書を提出する必要があります。
特に優先されるレポートは、オフラベルラベルに記載がない重篤な反応です。
すでに500万件を超えるレコードが収録されており、2010年には60万件を超えるレポートが寄せられました。
自発的な症例報告では、次のような情報を取得できます:
- 副作用の説明
- 被疑薬及び併用療法
- 患者の特徴、医学的および治療歴
- 診断
- 臨床経過と転帰
- 治療前、治療中、治療後の治療および検査値
- 再投与した場合の反応
などが該当します。
一方で、このような自発的な症例報告には、様々な因子が影響します。
例えば、メディアからの注目や訴訟(集団訴訟)といった、センシティブなものがあげられます。また、有害事象の重症度や、製剤の種類と適応症、市場で使用されてきた期間なども影響します。
また、製造業者の監視システムの範囲やその質などにも左右されます。
2. 研究や3. サーベイランスについて
症例報告以外にも、 市販後に行われる臨床試験や疫学研究があります( 観察研究やランダム比較試験)。こういった疫学研究はシグナル検出がけでなく、その評価にも利用されます。
また、薬剤の安全性のシグナル評価のため、サーベイランスが使用されることがあります。例えば、Sentinel Initiativeはこれに該当します。
Reporting Rateの推定について
有害事象の状況を把握しやすくするため、「レポートレート」の分母となる市販後曝露推定値(PMEE: post-marketing exposure estimate)を提供しています。
まれな状況を除いて、大部分の医薬品についてはどれだけ使用されているのかは分からないことが多いです。このため、まず分母となるPMEEを、販売データに基づいて報告されます。
近年は、様々なデータベースが使用できるようになったため、多くの製薬業者が、販売データとReal-world data(リアルワールドデータ)を組み合わせてPMEEを推定しています。
医療データベース内の治療パターンの評価 (年齢/性別など)をしながら、行われます。
時に、異なる地域内で経時的に評価する場合もあります。
一方で、Reporting rateの分子と分母の報告には限界があります。トレンドを評価するには、通常は時間(1つの時点ではなく)をかけて評価されます。長期的にはreporting rateが大きく変動することがあるからです。
データ収集の方法が時間の経過とともに一貫していると仮定すると、急増した場合は警告が示唆されることがあります。可能性があります。
これらの報告は重要ですが、因果関係を推察する上では、不十分な情報です。
FDA Sentinel Systemについて
2007年のFDA Amendments Actにより、FDAは以下の権限を持ちました:
- 医薬品の販売及び表示の管理
- 承認後試験の義務付け
- より大きな安全上のリスクを伴う医薬品には、リスク評価・リスク軽減戦略の要求
- 住民ベースの疫学的データシステムを活用
- 市販後調査を実施し、安全性シグナルを検出するこよ
などです。Sentinel Systemは、いわば「全国医薬品モニタリングシステム」です。
医薬品の安全性に懸念がある場合、電子医療データへの迅速かつ安全なアクセスを可能にするよう、データのインフラを整えています。
保険会社などデータのパートナーから、1億9300万人の患者データを集めています。
これを、ネットワーク上で記述的および推測的な分析が可能となっています。
FDAは今後5年間でデータ改善において4つを重要視しています:
- 妊娠中および出産後の医療製品の使用を評価
- 国および州のレジストリを統合する(例:NDI、SEER、希少疾患の登録)
- 電子カルテの連携強化
- PCOR-Netなどの他のパートナーにも拡大
これらを改善することで、疫学研究の対象集団、薬物への暴露、アウトカム、交絡因子などを利用可能にし、特別なプログラミングなしで分析を行うツールの標準化を目標にしています。
おわりに
今回は、薬剤疫学における医薬品承認後の研究と、アメリカのSentinel Systemについて簡単に説明しました。
次回は、薬剤疫学における研究デザインを少し解説できればと思います。