システマティック・レビューとメタ解析について① 〜イントロ編〜

「システマティック・レビューとメタ解析(Systematic Review & Meta-analyses)」と聞くと「最高峰のエビデンス(科学的根拠)」と考えるかもしれません。実は、Systematic Review & Meta-analysesといっても
- 質の高い研究があり(RCTなど)
- 文献をくまなく調査し
- 研究データを偏りなく評価し
- 正しい手法で導き出され
- 正しい解釈がされた
結果であれば、信頼性の高い結果になるでしょう。
しかし、研究者によりその方法論が甘かったり、判断の基準が甘かったり、ひどい場合には報告の仕方がお作法通りでないことがあります。
(お作法通りでない例↓↓)
もちろんSystematic Review & Meta-analysesの存在を否定するつもりは全くありません。
ですが、Systematic Review & Meta-analysesですら、研究の質はバラバラで、よい研究か否か見分ける力が必要です。
非常に酷な話に聞こえるかもしれませんが、少し知識があれば、「ある程度は」見分けることができます。
そこで、今回からSystematic Review & Meta-analysesについて解析しいきます。
システマティック・レビュー(Systematic Review)とは
Systematic Reviewは系統的レビューとも言われています。
その名の通り、過去に行われた研究を網羅的に調査し、質の高い研究を選び出し、偏りなく評価することをいいます。
システマティック・レビューの特徴
文献を「系統的に」調査をするには、4つほど注意点があり、
- 目的が明確であり、再現性のある方法である
- 該当する研究結果は全て確認する
- 対象となった研究結果の妥当性を評価する(バイアスなど)
- 結果を系統的に提示する
です。過去の研究数が少なかったり、質の高い研究結果がなければ、メタ解析は行われないこともあります。
なぜシステマティック・レビュー?
システマティック・レビューとメタ解析をするには、研究テーマにもよりますが、早くても3〜6ヶ月程度の時間を要します。
そのほとんどが文献の読み込みと評価で、非常に長い時間をかけてやる根気のいる作業です。「解析、難しくないですか?」と言われますが、そうでもありません。
最後の統計解析は簡単なものであれば、数時間あれば終わってしまうこともあるのです。
なぜこれだけの時間と労力をかけてシステマティック・レビューをするかというと、
- 医療者・研究者・政策者などに有益であるから
- 記述的レビュー(narative review)より客観的で、透明性が高い
- ある仮説のエビデンスが不十分であることも示せる(lack of evidence)
といった利点があるからです。
メタ解析について
メタ解析では、過去に行われた個々の研究結果を統合します。
「統合」するためには、
- 治療(Treatment)や暴露因子(exposure)とアウトカムが研究間で同等とみなせる
- 母集団によって治療効果が大きく変わらない
といった前提が必要になります。
なぜメタ解析をするのか?
過去の研究結果を統合することで
- 第二種過誤(Type II Error)が減る
- 一般化の向上(generalizability)
- 結果のばらつきの原因を同定できるかも(heterogeneity)
などの利点があります。
おまけ:第一種過誤(Type I error)と第二種過誤(Type II error)
Type IやType II errorと書かれると分かりづらいかもしれませんが、簡単にいうと
- Type I error は偽陽性
- Type II error は偽陰性
のことをいいます。

妊娠を例にいうと;
- 本当は妊娠していないのに「妊娠している」と言われるのがType I error
(偽陽性:false positive) - 本当は妊娠しているのに「妊娠していません」と言われるのがType II error
(偽陰性:false negative)
と理解すると分かりやすいかもしれません。
おまけ:Generalizaiblityとは?
Generalizabilityとは一般化可能性などと訳されています。実は類義語にTransportabilityという言葉もありますが、一部の疫学者はこの言葉を使い分けています。
例えば、Generalizabilityとは、例えば日本のとある地域で研究が行われた場合、この結果が日本全体に当てはまるか否かを議論する際に用いられます。
一方、Transportabilityとは、例えていうと、アメリカで行われた研究が、日本でも同様に当てはまるかを議論するか否かを言います。
*疫学者によって使い分けが違うので、そこは理解してあげましょう。
メタ解析が行われないケースがある理由
システマティック・レビューをしたけれどもメタ解析をしない場合もあります。
例えば、
- 研究間でのばらつきが大きすぎる
- 治療方法が大きく異なり、比較できない
- 治療のアウトカムが大きく異なる
- 研究デザインが異なる(RCTと症例対照研究)
- 参加者が大きく異なる
- データの数が少ない(最低でも5ー6個の研究が必要)
などの場合、メタ解析をせずに終わることもあります。
システマティック・レビューとメタ解析の限界
「Garbage in, Garbage out」:ゴミデータは価値がない
メタ解析に限ったことではありませんが、よく英語で『Garbage in, Garbage out』と言われますが、これは『無意味なデータをメタ解析しても、無意味な結果しか出てこない』ことを言います。
個々の研究の質が低ければ、メタ解析をしても質は低いままです。
例えば、メタ解析でも観察研究をもとにされているものもありますが、もとの研究がバイアスだらけだったら、メタ解析をしてもバイアスだらけで、その質は極めて低いです。
それぞれの研究の質の評価には;
- 選択バイアス(ドロップアウトの数など)
- 交絡
- 情報バイアス(計測エラーなど)
- 逆の因果
などに注意するとよいでしょう。
逆にいうと、メタ解析をする際に、個々の研究(主にRCT)の質を評価する力が研究者に求められます。
メタ解析をする前に、疫学の基本について、きちんと把握していることが望ましいです。なぜなら、疫学の基本を知らなければ、研究の質の評価ができないからです。
研究結果のばらつきについて
研究結果のばらつき(Heterogeneity)が大きすぎる時もメタ解析が行えなくなります。
例えば、
- 治療はアウトカムの発症を1/3にした(予防効果)
- 治療はアウトカムの発症を3倍にした(有害)
という2つの研究結果をまとめるのは難しくなります。
(2つの研究をあわせて1倍(効果なし)とするのはNG)
なぜかというと、この2つの研究結果から、同じ治療をしても
- 予防効果がある集団
- 危険性がある集団
という異なる2つの集団が存在することが予想されるからです。
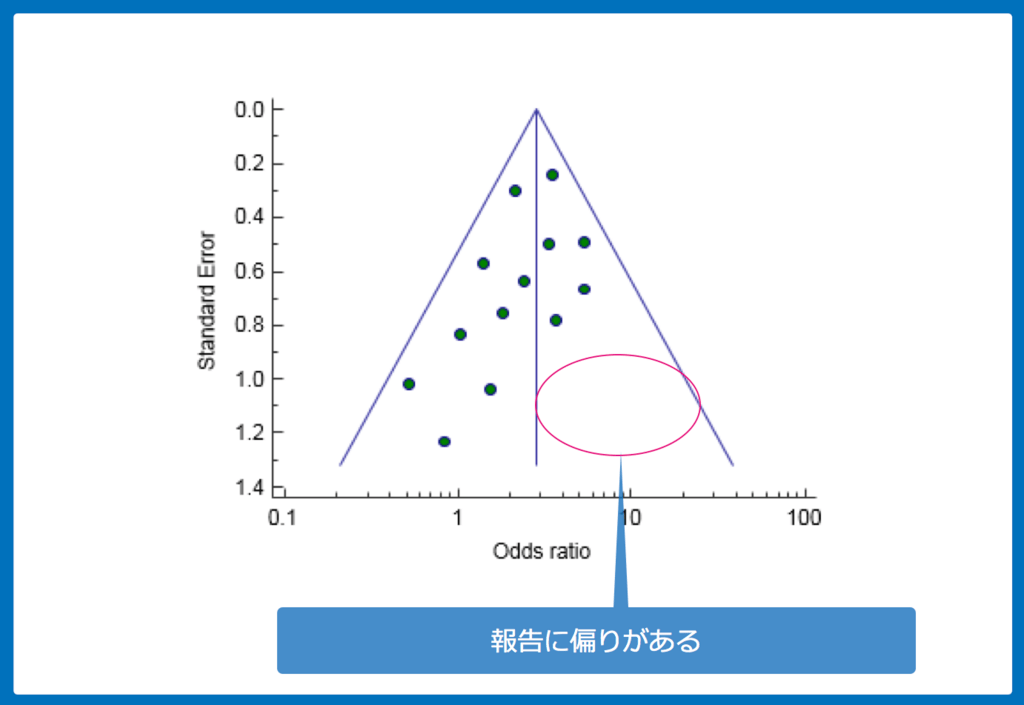
出版バイアスについて
メタ解析では出版バイアスの評価も必須です。
なぜなら、ほとんどのジャーナルは統計学的に有意であった研究は採択されやすく、その逆は採択されづらいからです。
出版バイアスは「funnel plot」と呼ばれる手法で確認することもできます。
まとめ
今回はシステマティック・レビューとメタ解析について簡単に解説してきました。
次回からは、それぞれの方法論を詳しく説明していこうと思います。
(続きはこちら↓↓)